在固有免疫中,模式识别受体(PRRs)通过二聚体化导致受体结构的改变,从而在配体结合及激活下游信号传导中展现多样性,调控机体免疫应答。近年来,PRRs中C型凝集素受体(CLRs)和Toll样受体(TLRs)均被发现能够形成同源或异源二聚体,在微生物感染中调控机体免疫应答,然而,在真菌感染中,CLR和TLR是否能够跨家族形成二聚体调控抗真菌免疫,尚不清楚。
10月23日,bat365中文官方网站贾鑫明教授团队在Nature Communications杂志发表研究论文“C-type lectin receptor 2d forms homodimers and heterodimers with TLR2 to negatively regulate IRF5-mediated antifungal immunity”,报道了在白念珠菌感染中,C型凝集素受体CLEC2D既能够形成同源二聚体,又能够与TLR2跨家族形成异源二聚体,并阐明了CLEC2D以二聚体形式负调控IRF5介导的抗真菌免疫新机制。该研究揭示了固有免疫中PRR二聚体化的功能多样性,为研发真菌感染的免疫治疗提供了新的策略。

研究发现CLEC2D与TLR2具有直接相互作用,在骨髓来源树突状细胞(BMDC)中CLEC2D与TLR2蛋白的相互作用在含β-葡聚糖的白念珠菌刺激下,进一步显著增加。还发现CLEC2D和TLR2的相互作用依赖于它们的细胞外结构域。利用双分子荧光互补(BiFC)研究发现,YFPN-CLEC2D 和YFPC-CLEC2D结合,或YFPN-CLEC2D和YFPC-TLR2结合均可在细胞表面形成复合物并发出荧光(图1h),表明CLEC2D既可以形成同源二聚体,又可以与TLR2形成异源二聚体。利用荧光共振能量转移(FRET)技术,进一步验证了内源性CLEC2D和TLR2在人外周血单核细胞(PBMCs)中的相互作用。在β-葡聚糖刺激后,我们观察到FRET效率显著增加,表明β-葡聚糖诱导加强了PBMC膜上的CLEC2D和TLR2之间的相互作用(图1)。
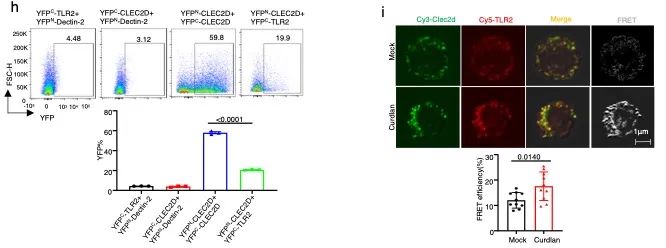
图1 . CLEC2D自身可形成同源二聚体,也可以与TLR2形成异源二聚体
还发现CLEC2D/TLR2异源二聚体和CLEC2D同源二聚体均能够高亲合力结合真菌来源β-葡聚糖。但与TLR2同源二聚体相比,CLEC2D/TLR2异源二聚体和CLEC2D同源二聚体对β-葡聚糖的结合能力更强。
为了探究CLEC2D同源二聚体和异源二聚体介导的固有免疫应答,研究者观察到BMDCs中Cle2d的缺失显著增强了β-葡聚糖诱导的IRF5磷酸化和入核。表明CLEC2D能够负调控β-葡聚糖诱导的IRF5激活。MyD88降解是TLR下游IRF5激活的关键调控蛋白之一,研究者发现:CLEC2D能够促进MyD88的泛素化和降解,从而抑制了β-葡聚糖诱导的IRF5激活。进一步研究发现:在β-葡聚糖刺激后,与野生型BMDCs相比,缺失Clec2d的BMDCs中Il12a (编码IL-12p35亚基)表达水平显著增高。还发现Clec2d缺失显著增加IRF5与Il12a启动子的结合,表明CLEC2D/TLR2异源二聚体和CLEC2D同源二聚体负调节IRF5介导的IL-12产生。研究者还发现,CLEC2D敲除小鼠对白念珠菌感染具有高度抗性,而骨髓细胞特异敲除CLEC2D能够显著提高白念珠菌感染小鼠的存活率。
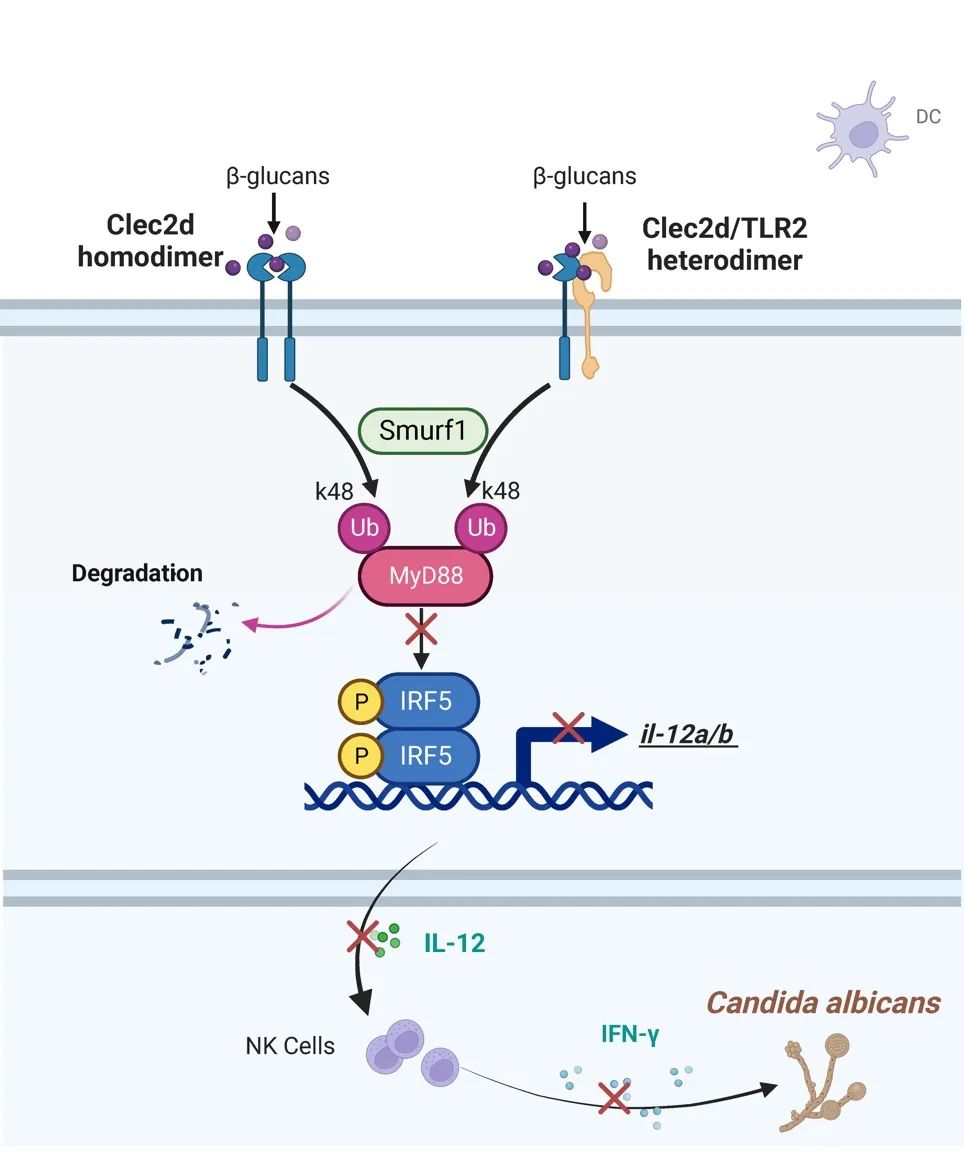
图2 . 在白念珠菌感染过程中,树突状细胞中的CLEC2D通过形成同源二聚体或与TLR2形成异源二聚体,以识别来自白念珠菌的β-葡聚糖。这一过程触发了smurf1介导的k48相关的MyD88泛素降解,从而抑制转录因子IRF5的激活和随后IL-12的产生。
综述所述,团队发现C型凝集受体CLEC2D能够特异结合真菌β-葡聚糖,并发现CLEC2D能够形成同源二聚体或与TLR2跨家族形成异源二聚体高亲和力结合β-葡聚糖,二聚体化的CLEC2D能够直接介导TLR2下游关键接头蛋白Myd88的泛素化降解,从而抑制转录因子IRF5的激活,以及IRF5介导的IL-12产生,促进真菌感染的免疫逃逸,最终发挥负向调控抗真菌免疫的新机制。该成果率先报道了C型凝集素受体形成同源二聚体或跨家族形成异源二聚体负调控抗真菌免疫的新模式,也为免疫学家理解不同家族受体发生互作协同调控免疫提供了全新的视角。
bat365中文官方网站贾鑫明教授和顾也博博士为本文的共同通讯作者。bat365官网登录博士生李帆、王慧为论文的共同第一作者。该研究得到了国家重点研发计划项目、国家自然科学基金项目、上海市教委创新计划项目、上海市科委基础研究重点基金项目、上海市实验动物研究基金项目、上海市卫健委项目、上海市科委扬帆项目的支持。
本文最后通讯作者,贾鑫明,现任bat365中文官方网站长聘教授,真菌感染与分子免疫课题组PI,博士生导师,长期聚焦研究真菌感染免疫研究。迄今以通讯或共同通讯作者在Immunity(2013)、J Exp Med(2014、2016)、Nat Immunol(2018)、Sci Adv(2021)、Cell Mol Immunol(2021)和Nat Commun(2022a、2022b、2023)等期刊发表研究论文20余篇。以第一完成人领衔获得2020年教育部自然科学一等奖。获聘担任上海市免疫学会感染免疫专委会副主任委员、中国细胞生物学学会免疫细胞生物学分会理事、上海市免疫学会第十二届理事会理事、中国微生物学会真菌学专委会委员、中国菌物学会医学真菌专业委员会委员和《中国真菌学》杂志编委,并受邀参与国际经典免疫学教材《詹韦免疫生物学》中文版的翻译工作,全国高等学校五年制本科临床医学专业第十轮规划教材《医学微生物》(第10版)编委、全国高等学校“十四五”医学规划新形态教材(药学类系列)《微生物学与免疫学》编委。
原文链接:https://www.nature.com/articles/s41467-023-42216-3?utm_source=rct_congratemailt&utm_medium=email&utm_campaign=oa_20231023&utm_content=10.1038/s41467-023-42216-3